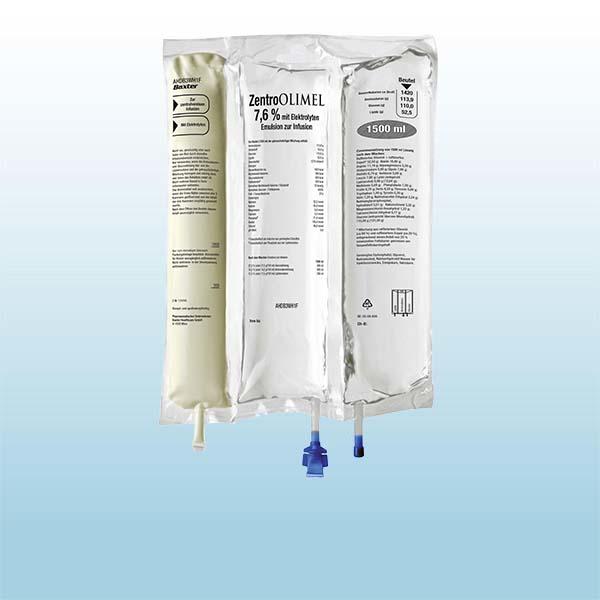
Finomel
Finomel hat einen höheren Fischölgehalt als alle anderen derzeit erhältlichen Dreikammer-Beutelsysteme.1-8

Finomel ist Baxters Dreikammerbeutel (3CB) für Ärzte, die bevorzugen, ihren erwachsenen Patienten mit parenteraler Ernährungstherapie ein fischölhaltiges Lipid zu verabreichen. Finomel enthält 20 % Omega-3-reiches Fischöl und liefert damit die von internationalen Leitlinien empfohlene Dosis Fischöl.1,2,9 Finomel ist in verschiedenen Beutelgrößen und Formulierungen zur zentralen und peripheren Verabreichung erhältlich, um die Nährstoffbedürfnisse von parenteralen Ernährungspatienten zu erfüllen.1,2
Vollständige Verschreibungsangaben für Finomel anzeigen.
Vollständige Verschreibungsangaben für Finomel Peri anzeigen.
Mehr Fischöl als andere 3CB
Mit 7,6 g/l Fischöl reich an Omega-3 enthält Finomel 33 % mehr Fischöl als jeder andere 3CB.1-8
Empfohlene Fischöldosis in weniger Flüssigkeit
Fischölgehalt liefert Finomel die in den ESPEN-Leitlinien empfohlene Tageszufuhr an Fischöl von 0,1–0,2 g/kg in weniger Flüssigkeit als alternative Lösungen.1-9
Ein ausgewogenes Lipidprofil mit vier Ölen.
Erfahren Sie mehr über klinische Ernährung

Besuchen Sie die Ressourcenbibliothek für klinische Ernährung, um auf weitere Ressourcen zuzugreifen.
Verwandte Produkte
Wichtige Sicherheitsinformationen
Finomel Emulsion zur Infusion
Pharmakotherapeutische Gruppe: Lösungen zur parenteralen Ernährung - Kombinationen,
ATC-Code: B05 BA10
Qualitative und quantitative Zusammensetzung
Finomel wird in einem Dreikammerbeutel aus Kunststoff geliefert. Jeder Beutel enthält eine sterile, pyrogenfreie Kombination aus einer 42%igen Glucoselösung, einer 10%igen Aminosäurenlösung mit Elektrolyten sowie eine 20%ige Lipidemulsion. Zusammensetzung der rekonstituierten Emulsion
nach dem Mischen des Inhalts der drei Kammern: Wirkstoff; 1.085 ml; 1.435 ml; 1.820 ml:Omega-3-Säuren-reiches Fischöl; 8,24 g; 10,92 g; 13,84 g; Raffiniertes Olivenöl; 10,30 g; 13,65 g; 17,30 g; Raffiniertes Sojaöl; 12,36 g; 16,38 g; 20,76 g; Mittelkettige Triglyceride; 10,30 g; 13,65 g; 17,30g; Alanin; 11,41 g; 15,09 g; 19,13 g;Arginin; 6,34 g; 8,38 g; 10,63 g;Glycin; 5,68 g; 7,51 g; 9,52 g;Histidin; 2,64 g; 3,50 g; 4,44 g; Isoleucin; 3,31 g; 4,37 g; 5,54 g;Leucin; 4,02 g; 5,32 g; 6,75 g;Lysin (als Lysinhydrochlorid); 3,20 g (3,99 g); 4,23 g (5,29 g); 5,36 g(6,70 g)Methionin; 2,20 g; 2,92 g; 3,70 g; Phenylalanin; 3,09 g; 4,08 g; 5,17 g; Prolin; 3,75 g; 4,96 g; 6,28 g; Serin; 2,76 g; 3,65 g; 4,62 g; Threonin; 2,31 g; 3,06 g; 3,88 g; Tryptophan; 0,99 g; 1,31 g; 1,66 g; Tyrosin; 0,22 g; 0,29 g; 0,37 g; Valin; 3,20 g; 4,23 g; 5,36 g; Natriumacetat-Trihydrat; 3,10 g; 4,10 g; 5,19 g; Kaliumchlorid; 2,47 g; 3,27 g; 4,14 g; Calciumchlorid-Dihydrat; 0,41 g; 0,54 g; 0,68 g; Magnesiumsulfat-Heptahydrat; 1,36 g; 1,80 g; 2,28 g; Wasserhaltiges Natriumglycerophosphat; 3,26 g; 4,32 g; 5,47 g; Zinksulfat-Heptahydrat; 0,013 g; 0,017 g; 0,021 g; Glucose (als Glucose-Monohydrat); 137,8 g (151,5 g); 181,9 g (200,0 g); 231,0 g (254,1g); Nährstoffzufuhr der gebrauchsfertigen Emulsion je Beutelgröße:; 1.085ml; 1.435 ml; 1.820 ml: Stickstoff (g); 9,1 ; 12,0; 15,3;Aminosäuren(g); 55; 73; 92; Glucose (g); 138; 182; 231; Lipidea (g); 44; 58; 73; Energie: Gesamtkalorien (kcal); 1184; 1567; 1988; Nichteiweiß-Kalorien (kcal); 964; 1276; 1619; Glucosekalorien (kcal)b; 571; 755; 958;Fettkalorien (kcal)c ; 393; 521; 661; Verhältnis Nichteiweiß-Kalorien/Stickstoff (kcal/g); 106; 106; 106;Verhältnis Glucose- / Fettkalorien; 59/41; 59/41; 59/41; Fett- / Gesamtkalorien; 33%; 33%; 33%;Elektrolyte: Natrium (mmol); 44,1; 58,3; 73,9;Kalium (mmol); 33,1; 43,8; 55,5; Magnesium (mmol); 5,5 ; 7,3; 9,3;Calcium (mmol); 2,8; 3,7; 4,7; Phosphat (mmol); 10,7/13,8d; 14,1/18,3d; 17,9/23,1d;Acetat (mmol); 79,5; 105; 133;Chlorid (mmol); 60,5; 80,1; 102;Sulfat (mmol); 5,6; 7,4; 9,3;Zink (mmol); 0,04; 0,06; 0,07;pH-Wert (ungefähr); 6,0; 6,0; 6,0;Osmolarität (ungefähr) (mOsm/L); 1440; 1440; 1440;Summe des Gehalts an Öl und Phospholipiden.; Summe des Gehalts an Glucose und Glycerol in g x 4 kcal/g. Summe des Gehalts an Phospholipiden in g x 9 kcal/g. Ohne Phosphat aus der Lipidemulsion/mit Phosphat aus der Lipidemulsion.
Liste der sonstigen Bestandteile:
Finomel enthält die folgenden sonstigen Bestandteile: Essigsäure 99 % (zur pH-Einstellung)Salzsäure 3,7 % (zur pH-Einstellung)
Phospholipide aus Eiern zur Injektion Glycerol Natriumoleat, All-rac-alpha-Tocopherol Natriumhydroxid 4,0 % (zur pH-Einstellung) Wasser für Injektionszwecke
Gegenanzeigen:
Überempfindlichkeit gegen Fisch-, Ei-, Soja-, Erdnussproteine, Mais/Maisprodukte (siehe Abschnitt 4.4) oder einen der Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile, schwere Hyperlipidämie, schwere Leberinsuffizienz, schwere Blutgerinnungsstörungen, angeborene Aminosäurenstoffwechselstörungen, schwere Niereninsuffizienz ohne Möglichkeiten zur Hämofiltration oder Dialyse, unkontrollierte Hyperglykämie, pathologisch erhöhter Serumspiegel eines der enthaltenen Elektrolyte, allgemeine Kontraindikationen einer Infusionstherapie: Akutes Lungenödem, Hyperhydratation und dekompensierte Herzinsuffizienz. instabile Zustände (z. B. schwere posttraumatische Zustände, dekompensierter Diabetes mellitus, akuter Myokardinfarkt, Schlaganfall, Embolie, metabolische Azidose, schwere Sepsis, hypotonische Dehydration und hyperosmolares Koma).
Inhaber der Zulassung: Baxter Healthcare GmbH A-1020 Wien
Stand der Information: Mai 2019
Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig
Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln oder sonstige Wechselwirkungen, Fertilität, Schwangerschaft und Stillzeit und Nebenwirkungen sind der veröffentlichten Fachinformation zu entnehmen.
Finomel Peri Emulsion zur Infusion
Pharmakotherapeutische Gruppe: Lösungen zur parenteralen Ernährung - Kombinationen,
ATC-Code: B05 BA10
Qualitative und Quantitative Zusammensetzung:
Finomel Peri wird in einem 3-Kammerbeutel aus Kunststoff geliefert. Jeder Beutel enthält eine sterile, pyrogenfreie Kombination aus einer 13%igen Glucoselösung, einer 10%igen Aminosäurenlösung mit Elektrolyten sowie eine 20%ige Lipidemulsion.
Zusammensetzung der rekonstituierten Emulsion nach dem Mischen des Inhalts der drei Kammern: Wirkstoff; 1.085 ml; 1.450 ml; 2.020 ml;Omega-3-Säuren-reiches Fischöl; 6,12 g; 8,16 g; 11,40 g; Raffiniertes Olivenöl; 7,65 g; 10,20 g; 14,25 g; Raffiniertes Sojaöl; 9,18 g; 12,24 g; 17,10 g; Mittelkettige Triglyceride; 7,65 g; 10,20 g; 14,25 g; Alanin; 7,08 g; 9,46 g; 13,17 g; Arginin; 3,93 g; 5,26 g; 7,31 g; Glycin; 3,52 g; 4,71 g; 6,55 g; Histidin; 1,64 g; 2,19 g; 3,05 g; Isoleucin; 2,05 g; 2,74 g; 3,82 g; Leucin; 2,50 g; 3,34 g; 4,64 g; Lysin (als Lysinhydrochlorid); 1,98 g (2,48 g); 2,65 g (3,31 g); 3,69 g (4,61g); Methionin; 1,37 g; 1,83 g; 2,54 g; Phenylalanin; 1,92 g; 2,56 g; 3,56 g; Prolin; 2,33 g; 3,11 g; 4,32 g; Serin; 1,71 g; 2,29 g; 3,18 g; Threonin; 1,44 g; 1,92 g; 2,67 g; Tryptophan; 0,62 g; 0,82 g; 1,14 g; Tyrosin; 0,14 g; 0,18 g; 0,25 g; Valin; 1,98 g; 2,65 g; 3,69 g; Natriumacetat-Trihydrat; 1,92 g; 2,57 g; 3,57 g; Kaliumchlorid; 1,53 g; 2,05 g; 2,85 g; Calciumchlorid-Dihydrat; 0,25 g; 0,34 g; 0,47 g; Magnesiumsulfat-Heptahydrat; 0,84 g; 1,13 g; 1,57 g; Wasserhaltiges Natriumglycerophosphat; 2,03 g; 2,71 g; 3,77 g; Zinksulfat-Heptahydrat; 0,008 g; 0,011 g; 0,015 g; Glucose(als Glucose-Monohydrat); 76,7 g(84,4 g); 102,6 g(112,8 g); 142,9 g(157,2 g) Nährstoffzufuhr der gebrauchsfertigen Emulsion je Beutelgröße:; 1.085 ml; 1.450 ml; 2.020 ml: Stickstoff (g); 5,6 ; 7,5; 10,5Aminosäuren(g); 34; 46; 64;Glucose (g); 77; 103; 143;Lipidea (g); 32; 43; 60;Energie:Gesamtkalorien (kcal); 751; 1003; 1398;Nichteiweiß-Kalorien (kcal); 614; 820; 1144;Glucosekalorien (kcal)b; 322; 431; 600;Fettkalorien (kcal)c ; 292; 389; 544;Verhältnis Nichteiweiß-Kalorien/ Stickstoff (kcal/g); 109; 109; 109; Verhältnis Glucose- / Fettkalorien; 52/48; 52/48; 52/48;Fett- / Gesamtkalorien; 39%; 39%; 39%;Elektrolyte: Natrium (mmol); 27,4; 36,6; 50,9;Kalium (mmol); 20,6; 27,5; 38,2;Magnesium (mmol); 3,4; 4,6; 6,4;Calcium (mmol); 1,7; 2,3; 3,2;Phosphat (mmol); 6,6/8,9d; 8,8/11,9d; 12,3/16,6d;Acetat (mmol); 49,3; 65,9; 91,7; Chlorid (mmol); 37,6; 50,2; 69,9;Sulfat (mmol); 3,5; 4,6; 6,4; Zink (mmol); 0,03; 0,04; 0,05;pH-Wert (ungefähr); 6,0; 6,0; 6,0;Osmolarität (ungefähr) (mOsm/L); 850; 850; 850;Summe des Gehalts an Öl und Phospholipiden.;Summe des Gehalts an Glucose und Glycerol in g x 4 kcal/g.;Summe des Gehalts an Phospholipiden in g x 9 kcal/g. Ohne Phosphat aus der Lipidemulsion/mit Phosphat aus der Lipidemulsion.
Vollständige Auflistung der sonstigen Bestandteile:
Finomel Peri enthält die folgenden sonstigen Bestandteile: Essigsäure 99 % (zur pH-Einstellung); Salzsäure 3,7 % (zur pH-Einstellung);Phospholipide aus Eiern zur Injektion Glycerol; Natriumoleat; All-rac-alpha-Tocopherol;Natriumhydroxid 4,0 % (zur pH-Einstellung); Wasser für Injektionszwecke
Anwendungsgebiete:
Finomel Peri ist indiziert für die parenterale Ernährung bei Erwachsenen, wenn eine orale oder enterale Ernährung nicht möglich, unzureichend oder kontraindiziert ist.
Gegenanzeigen:
Überempfindlichkeit gegen Fisch-, Ei-, Soja-, Erdnussproteine, Mais/Maisprodukte (siehe Abschnitt 4.4) oder einen der Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile, schwere Hyperlipidämie, schwere Leberinsuffizienz, schwere Blutgerinnungsstörungen, angeborene Aminosäurenstoffwechselstörungen, schwere Niereninsuffizienz ohne Möglichkeiten zur Hämofiltration oder Dialyse, unkontrollierte Hyperglykämie, pathologisch erhöhter Serumspiegel eines der enthaltenen Elektrolyte, allgemeine Kontraindikationen einer Infusionstherapie: Akutes Lungenödem, Hyperhydratation und dekompensierte Herzinsuffizienz. instabile Zustände (z. B. schwere posttraumatische Zustände, dekompensierter Diabetes mellitus, akuter Myokardinfarkt, Schlaganfall, Embolie, metabolische Azidose, schwere Sepsis, hypotonische Dehydration und hyperosmolares Koma).
Inhaber der Zulassung: Baxter Healthcare GmbH A-1020 Wien
Stand der Information: Mai 2019
Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig
Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln oder sonstige Wechselwirkungen, Fertilität, Schwangerschaft und Stillzeit und Nebenwirkungen sind der veröffentlichten Fachinformation zu entnehmen.